易文賽研究院發(fā)表論文探索臍帶干細(xì)胞來源外泌體在急性肺損傷治療中的作用

近日,易文賽研究院藥物研發(fā)團(tuán)隊(duì)在期刊《Journal of Cellular Biochemistry》發(fā)表研究論文“Umbilical cord MSC‐derived exosomes improve alveolarmacrophage function and reduce LPS‐induced acute lung injury”,論文聚焦分析臍帶間充質(zhì)干細(xì)胞(UCMSC)來源的外泌體(Exosomes)在脂多糖誘導(dǎo)的急性肺損傷模型中的治療作用及其機(jī)制,探索其臨床轉(zhuǎn)化潛力。

急性肺損傷(ALI) 是一種可經(jīng)多種感染因素如細(xì)菌、病毒感染和非感染性因素如吸入毒性氣體、大量輸血、藥物中毒、急性胰腺炎等引起的肺部肺泡上皮細(xì)胞和毛細(xì)血管內(nèi)皮細(xì)胞損傷的呼吸系統(tǒng)重癥。這種損傷導(dǎo)致肺血管通透性增加,進(jìn)而引起彌漫性肺間質(zhì)和肺泡水腫。如果不及時(shí)治療,ALI可發(fā)展為更嚴(yán)重的急性呼吸窘迫綜合征 (ARDS)。目前,尚無具體的ALI/ARDS藥物治療方案,最常通過氧療、機(jī)械通氣和控制肺部炎癥和液體積聚的藥物緩解患者癥狀。
現(xiàn)已有大量臨床研究探討利用間充質(zhì)干細(xì)胞作為COVID‐19引起的肺損傷的潛在治療方法。間充質(zhì)干細(xì)胞(Mesenchymal stem cells,MSCs) 作為 ALI和其他肺病的可能治療方法,在臨床前和臨床研究中顯示了極具前景的治療效果。
易文賽研發(fā)團(tuán)隊(duì)通過分析UCMSC來源Exosomes在脂多糖 (LPS)誘導(dǎo)的ALI模型中的作用機(jī)制,發(fā)現(xiàn)UCMSC來源的Exosomes(UCMSC-EXO)可有效改善肺泡巨噬細(xì)胞的代謝功能,并促進(jìn)其向抗炎表型的轉(zhuǎn)變,最終改善ALI。
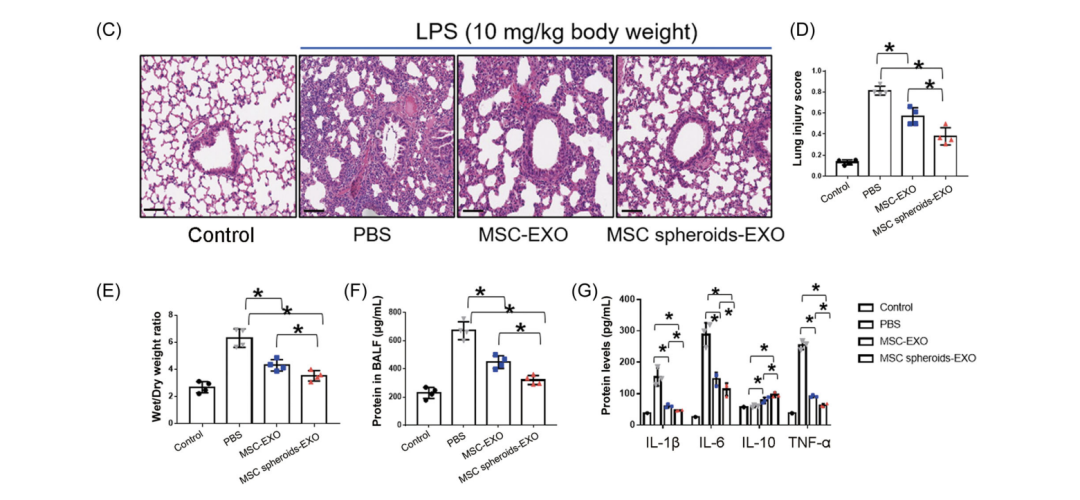
研究結(jié)果顯示,UCMSC-EXO治療可顯著抑制ALI小鼠內(nèi)皮和上皮通透性增加(p<0.05),肺損傷顯著下降,具體表現(xiàn)為炎性細(xì)胞浸潤(rùn)減少、肺泡壁變薄;而干細(xì)胞做3D微球培養(yǎng)后得到的外泌體對(duì)肺損傷的修復(fù)能力更強(qiáng)(圖2C,D)。同時(shí),兩個(gè)外泌體處理組也顯著抑制了肺濕/干比值(圖2E),并表現(xiàn)為與肺損傷評(píng)分降低、炎性細(xì)胞浸潤(rùn)減少、支氣管肺泡灌洗液 (BALF)中的蛋白滲漏減少(圖2F)。此外,外泌體處理顯著降低炎性細(xì)胞因子白細(xì)胞介素(IL)-1β、IL‐6和腫瘤壞死因子(TNF)‐α的表達(dá),而IL‐10水平升高(圖2G)。
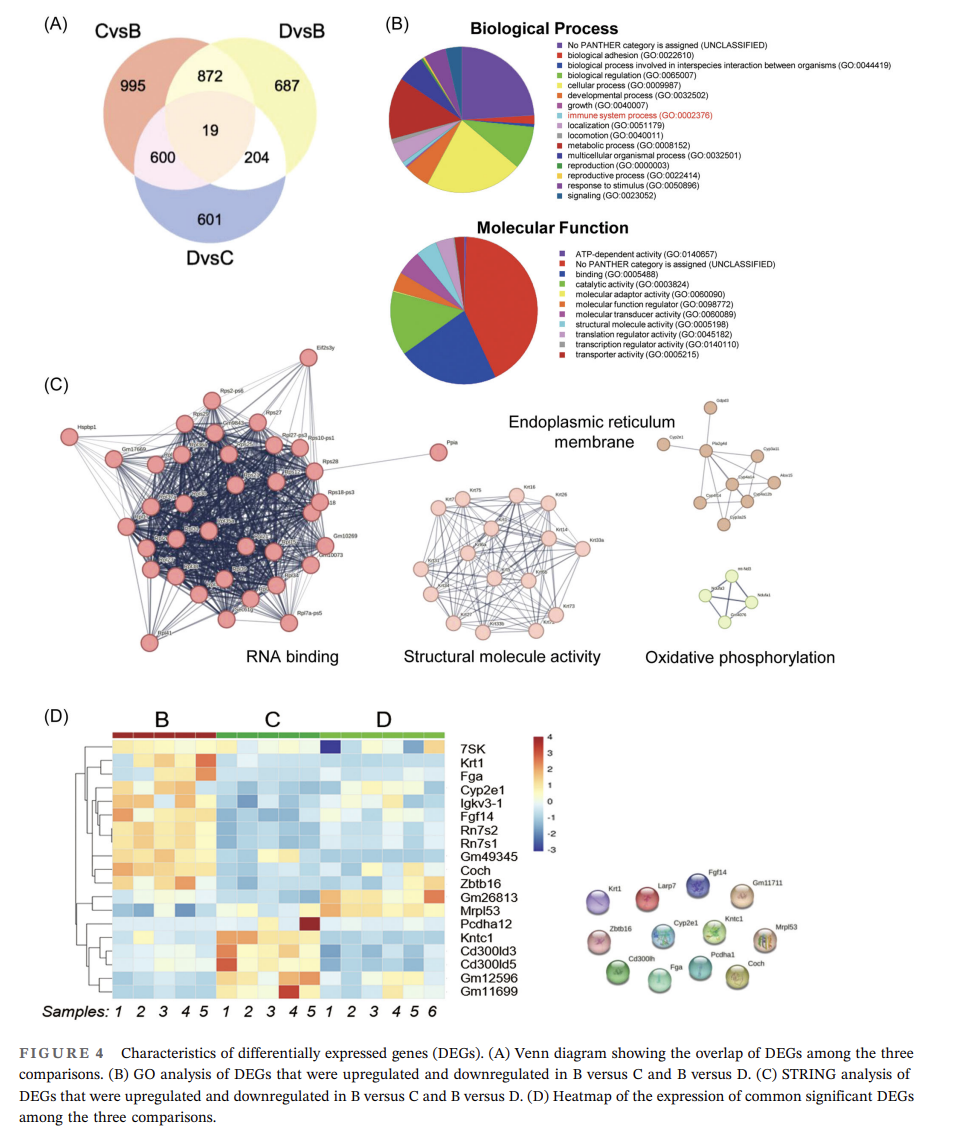
進(jìn)一步RNA-seq分析結(jié)果表明,各組間顯著差異表達(dá)基因(DEGs)從生物學(xué)過程角度看,主要富集在生物粘附、細(xì)胞過程和生物調(diào)控中;從分子功能角度看,DEGs主要富集在結(jié)合和催化活性上;STRING 分析表明,這些蛋白富集在 RNA 結(jié)合、結(jié)構(gòu)分子活性、內(nèi)質(zhì)網(wǎng)膜和氧化磷酸化中(圖4C)。此外,研究得到12個(gè)顯著DEGs:Larp7、Gm11711、Coch、Kntc1、Cd300lh、Fga、Pcdha1、Cyp2e1、Fgf14、Krt1、Zbtb16、Mrpl53(圖4D),均被證實(shí)與巨噬細(xì)胞極化相關(guān)。
(*巨噬細(xì)胞極化:當(dāng)機(jī)體內(nèi)環(huán)境穩(wěn)態(tài)遭到破壞時(shí),巨噬細(xì)胞通過吞噬、釋放炎癥因子等作用清除外源微生物,以恢復(fù)機(jī)體動(dòng)態(tài)平衡,這個(gè)過程稱為活化。伴隨著活化,在細(xì)胞因子的作用下,巨噬細(xì)胞改變其表型,以增強(qiáng)應(yīng)對(duì)微環(huán)境變化的能力,這個(gè)過程即為巨噬細(xì)胞的極化。巨噬細(xì)胞極化就是指成熟巨噬細(xì)胞在特殊微環(huán)境刺激下,產(chǎn)生不同功能表型的過程。巨噬細(xì)胞的極化對(duì)防御病原體、調(diào)節(jié)炎癥、修復(fù)組織和維持體內(nèi)平衡的穩(wěn)定有著十分重要的作用。)
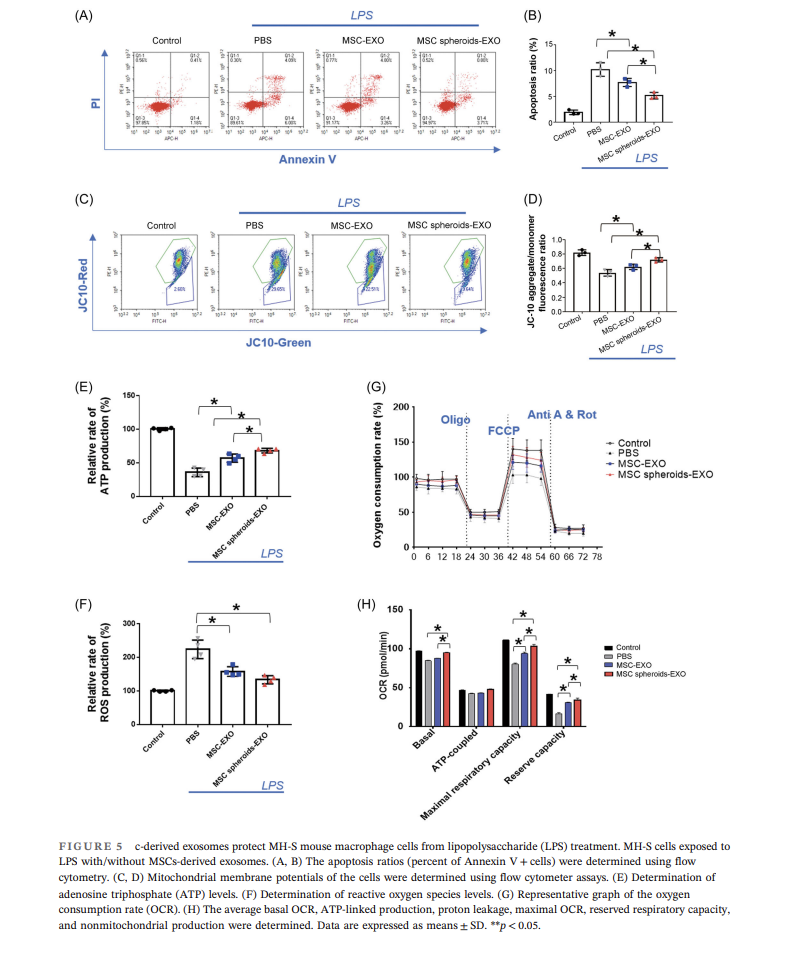
進(jìn)一步研究顯示UCMSC-EXO能夠在體外條件下更好地保護(hù)巨噬細(xì)胞:UCMSC-EXO能夠降低巨噬細(xì)胞凋亡水平,提高線粒體膜電位,促進(jìn)ATP生成,并降低ROS水平,且3D培養(yǎng)UCMSC所得外泌體效果更為顯著,上述結(jié)果可能是通過調(diào)控巨噬細(xì)胞能量代謝實(shí)現(xiàn)的(圖5)。
綜上,研究數(shù)據(jù)充分證明了UCMSC來源的外泌體在嚴(yán)重肺部炎癥進(jìn)程中的抗炎和組織保護(hù)作用,3D培養(yǎng)UCMSC EXO給藥效果更為明顯。盡管利用MSC來源的外泌體進(jìn)行疾病治療的研究仍處于早期階段,還需要更多研究來了解其潛在優(yōu)勢(shì)與作用機(jī)制。不可否認(rèn),其已成為干細(xì)胞研究領(lǐng)域的新熱點(diǎn),在未來疾病治療和組織修復(fù)應(yīng)用中極具潛力。















